Анемия , клинико-гематологический синдром, характеризующийся уменьшением содержания гемоглобина в единице объема крови, чаще при одновременном уменьшении количества эритроцитов, что приводит к развитию кислородного голодания тканей.
Принято считать анемией снижение уровня гемоглобина ниже 130 г/л и количества эритроцитов ниже 4 х 1012/л у мужчин и соответственно ниже 120 г/л и 3,7 х 1012/л у женщин.
Классификация анемий
Патогенетическая классификация анемий:
I. Анемии вследствие кровопотери (постгеморрагические).
- Острая
- Хроническая
II. Анемии вследствие нарушения образования эритроцитов и гемоглобина.
- Железодефицитная анемия.
- Мегалобластные анемии, связанные с нарушением синтеза ДНК. (В12, и фолиеводефицитные анемии)
- Анемии, связанные с костномозговой недостаточностью (гипопластические).
Ш. Анемии вследствие усиленного кроворазрушения (гемолитические).
IV. Анемии смешанные.
Классификация анемий по цветовому показателю:
I. Анемия гипохромная, цв. показатель ниже 0,8.
- железодефицитная анемия,
- тиреопривная анемия (при гипофункции щитовидной железы).
II. Анемия нормохромная, цв. показатель 0,85-1,05:
- анемия при хронической почечной недостаточности,
- гипопластическая (апластическая) анемия,
- лекарственная и лучевая цитостатическая болезнь,
- анемия при злокачественных новообразованиях и гемобластозах,
- анемия при системных заболеваниях соединительной ткани,
- , анемия при хроническом активном гепатите и циррозе печени,
- гемолитическая анемия (кроме талассемий),
- острая потгеморрагическая анемия.
III. Анемия гиперхромная, цв. показатель выше 1,05:
- В12-дефицитная анемия.
- фолиеводефицитная анемия.
Анемии вследствии нарушения образования эритроцитов и гемоглобина
Железодефицитная анемия
Железодефицитная анемия , это анемия, обусловленная дефицитом железа в сыворотке крови, костном мозге и депо. Люди, страдающие скрытым дефицитом железа и железодефицитной анемией, составляют 15-20% населения Земли. Наиболее часто железодефицитная анемия встречается среди детей, подростков, женщин детородного возраста, пожилых людей. Общепринято выделять две формы железодефицитных состояний: латентный дефицит железа и железодефицитную анемию. Латентный дефицит железа характеризуется уменьшением количества железа в его депо и снижением уровня транспортного железа крови при нормальных показателях гемоглобина и эритроцитов.
Основные сведения об обмене железа
Железо в организме человека участвует в регуляции обмена веществ, в процессах переноса кислорода, в тканевом дыхании и оказывает огромное влияние на состояние иммунологической резистентности. Почти все железо в организме человека входит в состав различных белков и ферментов. Можно выделить две его основные формы: гемовое (входящее в состав гема – гемоглобин, миоглобин) и негемовое. Железо гема мясных продуктов всасывается без участия соляной кислоты. Однако ахилия может в определенной мере способствовать развитию железодефицитной анемии при наличии значительных потерь железа из организма и высокой потребности в железе. Всасывание железа осуществляется преимущественно в двенадцатиперстной кишке и верхних отделах тощей кишки. Степень всасывания железа зависит от потребности организма в нем. При выраженном дефиците железа всасывание его может происходить и в остальных отделах тонкого кишечника. При уменьшении потребности организма в железе происходит снижение скорости поступления его в плазму крови и увеличивается отложение в энтероцитах в виде ферритина, который элиминируется при физиологическом слущивании эпителиальных клеток кишечника. В крови железо циркулирует в комплексе с плазменным трансферином. Этот белок синтезируется преимущественно в печени. Трансферин захватывает железо из энтероцитов, а также из депо в печени и селезенке и переносит его к рецепторам на эритрокариоцитах костного мозга. В норме трансферин насыщен железом приблизительно на 30%. Комплекс трансферин-железо взаимодействует со специфическими рецепторами на мембране эритрокариоцитов и ретикулоцитов костного мозга, после чего путем эндоцитоза проникает в них, железо переносится в их митохондрии, где включается в протопрорфирин и таким образом участвует в образовании гема. Освободившийся от железа трансферин неоднократно участвует в переносе железа. Затраты железа на эритропоэз составляют 25 мг в сутки, что весьма значительно превышает возможности всасывания железа в кишечнике. В связи с этим для гемопоэза постоянно используется железо, освобождающееся при распаде эритроцитов в селезенке. Хранение (депонирование) железа осуществляется в депо , в составе белков ферритина и гемосидерина.
Наиболее распространенная форма депонирования железа в организме — ферритин. Он представляет собой водорастворимый гликопротеиновый комплекс, состоящий из расположенного в центре железа, покрытого белковой оболочкой из апоферритина. Каждая молекула ферритина содержит от 1000 до 3000 атомов железа. Ферритин определяется почти во всех органах и тканях, но наибольшее его количество обнаруживается в макрофагах печени, селезенки, костного мозга, эритроцитах, в сыворотке крови, в слизистой оболочке тонкой кишки. При нормальном балансе железа в организме устанавливается своеобразное равновесие между содержанием ферритина в плазме и депо (прежде всего в печени и селезенке). Уровень ферритина в крови отражает количество депонированного железа. Ферритин создает запасы железа в организме, которые могут быстро мобилизоваться при повышении потребности тканей в железе. Другая форма депонирования железа , гемосидерин — малорастворимое производное ферритина с более высокой концентрацией железа, состоящее из агрегатов кристаллов железа, не имеющих апоферритиновой оболочки. Гемосидерин накапливается в макрофагах костного мозга, селезенки, в купферовских клетках печени.
Физиологические потери железа
Потеря железа из организма мужчин и женщин происходит следующими путями:
- с калом (железо, не всосавшееся из пищи, железо, выделяющееся с желчью, железо в составе слущивающегося эпителия кишечника, железо эритроцитов в кале),
- со слущивающимся эпителием кожи,
- с мочой.
Указанными путями происходит выделение около 1 мг железа за сутки. Кроме того, у женщин детородного периода дополнительные потери железа возникают за счет менструаций, беременности, родов, лактации.
Этиология
Хронические кровопотери
Хронические кровопотери являются одной из самых частых причин железодефицитной анемии. Наиболее характерны необильные, но длительные кровопотери, которые незаметны для больных, но постепенно снижают запасы железа и приводят к развитию анемии.
Основные источники хронических кровопотерь
 Маточные кровопотери , самая частая причина железодефицитной анемии у женщин. У пациенток репродуктивного возраста чаще всего речь идет о длительных и обильных кровопотерях во время менструации. Нормальной считается менструальная кровопотеря, составляющая 30-60 мл (15-30 мг железа). При полноценном питании женщины (с включением мяса, рыбы и других железосодержащих продуктов) из кишечника максимально может всосаться ежедневно 2 мг, а за месяц — 60 мг железа и, следовательно, при нормальной менструальной кровопотере анемия не развивается. При большем объеме ежемесячной менструальной кровопотери разовьется анемия.
Маточные кровопотери , самая частая причина железодефицитной анемии у женщин. У пациенток репродуктивного возраста чаще всего речь идет о длительных и обильных кровопотерях во время менструации. Нормальной считается менструальная кровопотеря, составляющая 30-60 мл (15-30 мг железа). При полноценном питании женщины (с включением мяса, рыбы и других железосодержащих продуктов) из кишечника максимально может всосаться ежедневно 2 мг, а за месяц — 60 мг железа и, следовательно, при нормальной менструальной кровопотере анемия не развивается. При большем объеме ежемесячной менструальной кровопотери разовьется анемия.
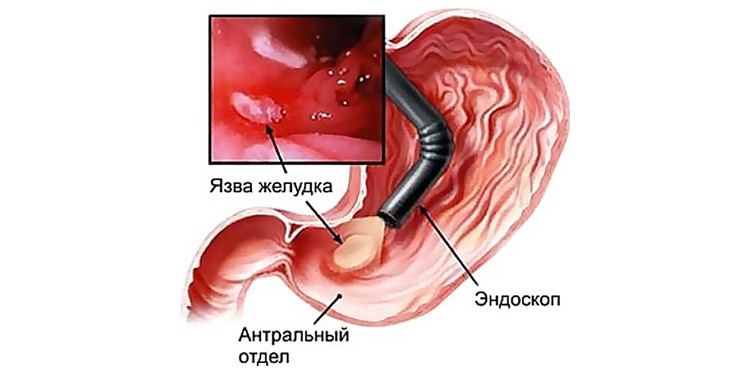 Хронические кровотечения из желудочно-кишечного тракта , наиболее частая причина железодефицитной анемии у мужчин и неменструирующих женщин. Источниками желудочно-кишечных кровотечений могут являться эрозии и язвы желудка и 12-перстной кишки, рак желудка, полипоз желудка, эрозивный эзофагит, диафрагамальная грыжа, десневые кровотечения, рак пищевода, варикозное расширение вен пищевода и кардиального отдела желудка (при циррозе печени и других формах портальной гипертензии), рак кишечника, дивертикулярная болезнь желудочно-кишечного тракта, полипы толстого кишечника, кровоточащий геморрой.
Хронические кровотечения из желудочно-кишечного тракта , наиболее частая причина железодефицитной анемии у мужчин и неменструирующих женщин. Источниками желудочно-кишечных кровотечений могут являться эрозии и язвы желудка и 12-перстной кишки, рак желудка, полипоз желудка, эрозивный эзофагит, диафрагамальная грыжа, десневые кровотечения, рак пищевода, варикозное расширение вен пищевода и кардиального отдела желудка (при циррозе печени и других формах портальной гипертензии), рак кишечника, дивертикулярная болезнь желудочно-кишечного тракта, полипы толстого кишечника, кровоточащий геморрой.
Кроме того, железо может теряться при носовых кровотечениях, при кровопотерях в результате заболеваний легких (при туберкулезе легких, бронхоэктазах, раке легкого).
Ятрогенные кровопотери — это кровопотери, обусловленные врачебными манипуляциями. Это редкие причины железодефицитной анемии. К ним относятся частые кровопускания у больных полицитемией, кровопотери во время процедур гемодиализа у больных хронической почечной недостаточностью, а также донорство (приводит к развитию скрытого дефицита железа у 12% мужчин и 40% женщин, а при многолетнем стаже провоцирует развитие железодефицитной анемии).
Повышенная потребность в железе
Повышенная потребность в железе также может привести к развитию железодефицитной анемии.
Беременность, роды и лактация , в эти периоды жизни женщины расходуется значительное количество железа. Беременность – 500 мг железа (300 мг – ребенку, 200 мг , плацента). В родах теряется – 50 – 100 мг Fe. При лактации теряется 400 , 700 мг Fe. Для восстановления запасов железа требуется не менее 2,5-3 лет. Следовательно, у женщин с интервалами между родами менее 2,5-3 лет легко развивается железодефицитная анемия.
Период полового созревания и роста , довольно часто сопровождается развитием железодефицитной анемии. Развитие железодефицитной анемии обусловлено повышением потребности в железе в связи с интенсивным ростом органов и тканей. У девушек играют роль также и такие факторы, как появление кровопотерь вследствие менструаций и нерациональное питание в связи с желанием похудеть.
Повышенная потребность в железе у больных В 12-дефицитной анемией может наблюдаться на фоне лечения витамином В12, что объясняется интенсификацией нормобластического кроветворения и использованием для этих целей больших количеств железа.
Интенсивные занятия спортом в некоторых случаях могут способствовать развитию железодефицитной анемии, особенно если ранее имелся скрытый дефицит железа. Развитие анемии при интенсивных спортивных нагрузках обусловлено повышением потребности в железе при больших физических нагрузках, увеличением мышечной массы (и, следовательно, использованием большего количества железа для синтеза миоглобина).
Недостаточное поступление железа с пищей
Алиментарная железодефицитная анемия, обусловленная недостаточным поступлением железа с пищей, развивается у строгих вегетарианцев, у лиц с низким социально-экономическим уровнем жизни, у больных с психической анорексией.
Нарушение всасывания железа
Основными причинами, приводящими к нарушению всасывания железа в кишечнике и развитию вследствие этого железодефицитной анемии, являются: хронические энтериты и энтеропатии с развитием синдрома мальабсорбции, резекция тонкой кишки, резекция желудка по методу Бильрот II («конец в бок»), когда происходит выключение части 12-перстной кишки. При этом железодефицитная анемия часто сочетается в В12-(фолиево)-дефицитной анемией в связи с нарушением всасывания витамина В12 и фолиевой кислоты.
Нарушения транспорта железа
Железодефицитная анемия, обусловленная снижением содержания в крови трансферина и, следовательно, нарушением транспорта железа, наблюдается при врожденной гипо- и атрансферинемии, гипопротеинемиях различного генеза, появлении антител к трансферину.
Патогенез
В основе всех клинических проявлений железодефицитной анемии лежит дефицит железа, который развивается в тех случаях, когда потери железа превышают его поступление с пищей (2 мг/сутки). Первоначально уменьшаются запасы железа в печени, селезенке, костном мозге, что получает отражение в снижении уровня ферритина в крови. На этой стадии происходит компенсаторное усиление всасывания железа в кишечнике и повышение уровня мукозного и плазменного трансферина. сывороточного железа еще не снижено, анемии нет. Однако в дальнейшем истощенные депо железа уже не способны обеспечить эритропоэтическую функцию костного мозга и, несмотря на сохраняющийся высокий уровень трансферина в крови, значительно снижаются содержание железа в крови (транспортное железо), синтез гемоглобина, развиваются анемия и последующие тканевые нарушения.
При дефиците железа снижается активность железосодержащих и железозависимых ферментов в различных органах и тканях, а также уменьшается образование миоглобина. В результате указанных нарушений и снижения активности ферментов тканевого дыхания (цитохромоксидаз) наблюдаются дистрофические поражения эпителиальных тканей (кожи, ее придатков, слизистой оболочки, желудочно-кишечного тракта, нередко — мочевыводящих путей) и мускулатуры (миокарда и скелетной мускулатуры).
Снижение активности некоторых железосодержащих ферментов в лейкоцитах нарушает их фагоцитарную и бактерицидную функции и угнетает защитные иммунные реакции.
Классификация железодефицитной анемии
Стадии
- 1 стадия — дефицит железа без клиники анемии (латентная анемия)
- 2 стадия —железодефицитная анемия с развернутой клинико-лабораторной картиной
Степень тяжести
- Легкая (содержание Нb 90-120 г/л)
- Средняя (содержание Нb 70-90 г/л)
- Тяжелая (содержание Нb ниже 70 г/л)
Клиническая картина
Клинические проявления железодефицитной анемии можно сгруппировать в два важнейших синдрома — анемический и сидеропенический.
Анемический синдром
Анемический синдром обусловлен снижением содержания гемоглобина и количества эритроцитов, недостаточным обеспечением тканей кислородом и представлен неспецифическими симптомами. Больные жалуются на общую слабость, повышенную утомляемость, снижение работоспособности, головокружение, шум в ушах, мелькание мушек перед глазами, сердцебиения, одышку при физической нагрузке, появление обморочных состояний. Может появляться снижение умственной работоспособности, памяти, сонливость. Субъективные проявления анемического синдрома вначале беспокоят больных при физической нагрузке, а затем и в покое (по мере роста анемии).
При объективном исследовании обнаруживается бледность кожи и видимых слизистых оболочек. Нередко обнаруживается некоторая пастозность в области голеней, стоп, лица. Характерны утренние отеки — «мешки» вокруг глаз.
Анемия обусловливает развитие синдрома миокардиодистрофии, который проявляется одышкой, тахикардией, часто аритмией, умеренным расширением границ сердца влево, глухостью тонов сердца, негромким систолическим шумом во всех аускультативных точках. При тяжелой и длительной анемии миокардиодистрофия может привести к выраженной недостаточности кровообращения. Железодефицитная анемия развивается постепенно, поэтому организм больного постепенно адаптируется и субъективные проявления анемического синдрома не всегда бывают ярко выражены.
Сидеропенический синдром
Сидеропенический синдром (синдром гипосидероза) обусловлен тканевым дефицитом железа, что приводит к снижению активности многих ферментов (цитохромоксидаза, пероксидаза, сукцинат-дегидрогеназа и др.). Сидеропенический синдром проявляется многочисленными симптомами:
- извращение вкуса (pica chlorotica) , непреодолимое желание употреблять в пищу что-либо необычное и малосъедобное (мел, зубной порошок, уголь, глину, песок, лед), а также сырое тесто, фарш, крупу, этот симптом чаще встречается у детей и подростков, но достаточно часто и у взрослых женщин,
- пристрастие к острой, соленой, кислой, пряной пище,
- извращение обоняния — пристрастие к запахам, которые большинством окружающих воспринимаются как неприятные (бензин, ацетон, запах лаков, красок, гуталина и др.),
- выраженная мышечная слабость и утомляемость, атрофия мышц и снижение мышечной силы в связи с дефицитом миоглобина и ферментов тканевого дыхания,
- дистрофические изменения кожи и ее придатков (сухость, шелушение, склонность к быстрому образованию на коже трещин, тусклость, ломкость, выпадение, раннее поседение волос, истончение, ломкость, поперечная исчерченность, тусклость ногтей, симптом койлонихии — ложкообразная вогнутость ногтей),
- ангулярный стоматит — трещины, «заеды» в углах рта (встречаются у 10-15% больных),
- глоссит (у 10% больных) — характеризуется ощущением боли и распирания в области языка, покраснением его кончика, а в дальнейшем атрофией сосочков («лакированный» язык), часто наблюдается склонность к пародонтозу и кариесу,
- атрофические изменения слизистой оболочки желудочно-кишечного тракта — это проявляется сухостью слизистой оболочки пищевода и затруднениями, а иногда болями при глотании пищи, особенно сухой (сидеропеническая дисфагия), развитием атрофического гастрита и энтерита,
- симптом «синих склер» характеризуется синеватой окраской или выраженной голубизной склер. Это объясняется тем, что при дефиците железа нарушается синтез коллагена в склере, она истончается и через нее просвечивает сосудистая оболочка глаза.
- императивные позывы на мочеиспускание, невозможность удержать мочу при смехе, кашле, чихании, возможно даже ночное недержание мочи, что обусловлено слабостью сфинктеров мочевого пузыря,
- «сидеропенический субфебрилитет» — характеризуется длительным повышением температуры до субфебрильных величин,
- выраженная предрасположенность к острым респираторно-вирусным и другим инфекционно-воспалительным процессам, хронизации инфекций, что обусловлено нарушением фагоцитарной функции лейкоцитов и ослаблением системы иммунитета,
- снижение репаративных процессов в коже, слизистых оболочках.
Лабораторные данные
Диагностика латентного дефицита железа
Латентный дефицит железа диагностируется на основании следующих признаков:
- анемия отсутствует, содержание гемоглобина нормальное,
- имеются клинические признаки сидеропенического синдрома в связи со снижением тканевого фонда железа,
- сывороточное железо снижено, что отражает уменьшение транспортного фонда железа,
- общая железосвязывающая способность сыворотки крови (ОЖСС) повышена. Этот показатель отражает степень «голодания» сыворотки крови и насыщения железом трансферина.
При дефиците железа процент насыщения трансферина железом снижен.
Диагностика железодефицитной анемии
При снижении гемоглобинового фонда железа появляются характерные для железодефицитной анемии изменения в общем анализе крови:
- снижение гемоглобина и эритроцитов в крови,
- снижение среднего содержания гемоглобина в эритроцитах,
- снижение цветового показателя (железодефицитная анемия является гипохромной),
- гипохромия эритроцитов, характеризующаяся их бледным прокрашиванием и появление просветления в центре,
- преобладание в мазке периферической крови среди эритроцитов микроцитов , эритроцитов уменьшенного диаметра,
- анизоцитоз — неодинаковая величина и пойкилоцитоз , различная форма эритроцитов,
- нормальное содержание ретикулоцитов в периферической крови, однако, после лечения препаратами железа возможно увеличение количества ретикулоцитов,
- тенденция к лейкопении, количество тромбоцитов обычно нормальное,
- при выраженной анемии возможно умеренное увеличение СОЭ (до 20-25 мм/ч).
Биохимический анализ крови — характерно снижение уровня сывороточного железа и ферритина. Могут отмечаться также изменения, обусловленные основным заболеванием.
Лечение железодефицитной анемии
Лечебная программа включает:
- Устранение этиологических факторов.
- Лечебное питание.
- Лечение железосодержащими препаратами.
3.1. Устранение дефицита железа и анемии.
3.2. Восполнение запасов железа (терапию насыщения).
3.3. Противорецидивную терапию.
4. Профилактику железодефицитной анемии.
4.1. Первичную.
4.2. Вторичную.
Устранение этиологических факторов
Ликвидация дефицита железа и, следовательно, излечение железодефицитной анемии возможно только после устранения причины, ведущей к постоянному дефициту железа.
Лечебное питание
При железодефицитной анемии больному показана диета, богатая железом. Максимальное количество железа, которое может всосаться из пищи в желудочно-кишечном тракте, — 2 г в сутки. Железо из продуктов животного происхождения всасывается в кишечнике в больших количествах, чем из растительных продуктов. Лучше всего всасывается двухвалентное железо, входящее в состав гема. Железо мяса всасывается лучше, а железо печени хуже, поскольку железо в печени содержится преимущественно в виде ферритина, гемосидерина, а также в виде гема. В малом количестве железо всасывается из яиц, фруктов. Лучше всего всасывается железо из телятины (22%), рыбы (11%). Из яиц, фасоли, фруктов всасывается лишь 3% железа.
Для нормального кроветворения необходимо получать с пищей, кроме железа, также другие микроэлементы. Диета больного железодефицитной анемией должна включать 130 г белков, 90 г жира, 350 г углеводов, 40 мг железа, 5 мг меди, 7 мг марганца, 30 мг цинка, 5 мкг кобальта, 2 г метионина, 4 г холина, витамины групп В и С.
При железодефицитной анемии может быть рекомендован также фито сбор, включающий листья крапивы, череды, земляники, черной смородины. Одновременно рекомендуется принимать отвар или настой плодов шиповника по 1 стакану в течение дня. Настой шиповника содержит железо и витамин С.
Лечение железосодержащими препаратами
Устранение дефицита железа
Поступление железа с пищей способно восполнить лишь нормальную суточную его потерю. Применение препаратов железа является патогенетическим методом лечения железодефицитной анемии. В настоящее время применяются препараты, содержащие двухвалентное железо (Fe++), так как оно значительно лучше всасывается в кишечнике. Препараты железа обычно применяются внутрь. Для обеспечения нарастающего повышения уровня гемоглобина необходимо принимать ежедневно такое количество железосодержащих препаратов, чтобы оно соответствовало суточной дозе двухвалентного железа от 100 мг (минимальная доза) до 300 мг (максимальная доза). Выбор суточной дозы в указанных дозах определяется преимущественно индивидуальной переносимостью препаратов железа и выраженностью дефицита железа. Назначать более 300 мг двухвалентного железа в сутки бесполезно, так как объем его всасывания при этом не возрастает.
Препараты двухвалентного железа назначаются за 1 ч до еды или не ранее чем через 2 ч после еды. Для лучшего всасывания железа одновременно принимают аскорбиновую или янтарную кислоту, всасывание увеличивается также в присутствии фруктозы.
- Ферро-фольгамма (комплекс железа сульфата 100 мг + аскорбиновая к-та 100 мг + фолиевая к-та 5мг + цианокобаламин 10 мг). Принимают по 1-2 капс 3 раза в день после еды.
- Ферроплекс — комплекс железа сульфата и аскорбиновой кислоты, назначается по 2-3 драже 3 раза в день.
- Гемофер пролонгатум — препарат продленного действия (железа сульфата 325 мг), по 1-2 таблетки в день.
Лечение железосодержащими препаратами проводится в максимально переносимой дозе до полной нормализации содержания гемоглобина, что происходит через 6-8 недель. Клинические признаки улучшения появляются значительно раньше (уже через 2-3 дня) по сравнению с нормализацией уровня гемоглобина. Это связано с поступлением железа в ферменты, дефицит которых обусловливает мышечную слабость. гемоглобина начинает возрастать на 2-3-й неделе от начала лечения. Железосодержащие препараты, как правило, принимают внутрь. При нарушении процессов всасывания железа из желудочно-кишечного тракта препараты назначают парентерально.
Восполнение запасов железа (терапия насыщения)
Запасы железа (депо железа) в организме представлены железом ферритина и гемосидерина печени и селезенки. Для восполнения запасов железа после достижения нормального уровня гемоглобина проводят лечение железосодержащими препаратами в течение 3 месяцев в суточной дозе, которая в 2-3 раза меньше по сравнению с дозой, применявшейся на этапе купирования анемии.
Противорецидивная (поддерживающая) терапия
При продолжающихся кровотечениях (например, обильных менструациях) показан прием препаратов железа короткими курсами по 7-10 дней ежемесячно. При рецидиве анемии показано проведение повторного курса лечения в течение 1-2 мес.
Профилактика железодефицитной анемии
Лицам с ранее излеченной железодефицитной анемией при наличии условий, угрожающих развитием рецидива железодефицитной анемии (обильные менструации, фибромиома матки и др.) проводится профилактика анемии. Рекомендуется профилактический курс длительностью 6 недель (суточная доза железа 40 мг), затем проводятся два 6-недельных курса в год или прием 30-40 мг железа ежедневно в течение 7-10 дней после менструации. Кроме того, необходимо ежедневно употреблять не менее 100 грамм мяса.
Меголобластные анемии
Мегалобластные анемии , это группа анемий, обусловленных нарушением синтеза ДНК в эритрокариоцитах вследствие дефицита витамина В12 и/или фолиевой кислоты и характеризующихся мегалобластным типом кроветворения.
В12-дефицитная анемия
Основные сведения о метаболизме витамина В12
Витамин В12 поступает в организм человека с пищей. Он содержится в мясе, печени, почках, яичном желтке, сыре, молоке, черной икре. В пище витамин В12 связан с белком. При кулинарной обработке пищи, а также в желудке под действием соляной кислоты и протеолитических ферментов витамин В12высвобождается из пищи. Далее в желудке витамин В12 (внешний фактор Касла) соединяется с белками «R» (Rapid-binders). Затем комплекс «витамин В12 + белок «R»» поступает в 12-перстную кишку, где под влиянием протеолитических ферментов панкреатического сока белок «R» отщепляется и освободившийся В12 соединяется с гастромукопротеином (внутренний фактор Касла), поступившим сюда из желудка. Гастромукопротеин вырабатывается париетальными клетками в фундальной части и в области тела желудка. Щелочная среда содержимого 12-перстной кишки усиливает связь витамина В12 и гастромукопротеина. Гастромукопротеин защищает витамин В12 от воздействия протеолитических ферментов. Далее комплекс «витамин В12+ гастромукопротеин» продвигается по тонкому кишечнику и поступает в подвздошную кишку, где в присутствии ионов Са2+ взаимодействует со специфическими рецепторами, после чего расщепляется, и витамин В12 поступает в митохондрии клеток слизистой оболочки. Отсюда витамин В12 проникает в кровь, где соединяется с транспортными белками — транскобаламинами и доставляется к печени и костному мозгу. В этих органах витамин В12высвобождается из комплекса витамин В12 + транскобаламин. Часть комплекса элиминируется с желчью. В костном мозге витамин В12 используется для кроветворения, в печени — депонируется и в дальнейшем поступает при необходимости в кровь. Часть витамина В12 из печени в составе желчи снова поступает в 12-перстную кишку и в дальнейшем всасывается согласно вышеописанному механизму.
При полноценном питании суточный рацион человека содержит до 30 мкг витамина В12. Суточная потребность в нем составляет 2-7 мкг. За сутки всасывается в кишечнике около 6-9 мкг витамина В12. В организме здорового человека содержится около 2-5 мг витамина В12. Основным органом, в котором содержится наибольшее количество кобаламина, является печень. Запасов витамина В12 в печени хватает на 3-5 лет после прекращения его всасывания.
Свою биологическую роль витамин В12 выполняет в виде двух коферментов , метилкобаламина и дезоксиаденозилкобаламина. Превращение свободного витамина В12 в В12-коферменты протекает в несколько этапов при участии специфических ферментов. С помощью этих коферментов витамин В12осуществляет две важнейшие реакции.
Первая реакция протекает с участием кофермента метилкобаламина и обеспечивает созревание, развитие и размножение клеток системы кроветворения, прежде всего красного кроветворного ростка и эпителия желудочно-кишечного тракта.
Вторая реакция , расщепление и синтез жирных кислот протекает с участием кофермента дезоксиаденозилкобаламина и обеспечивает превращение продукта метаболизма жирных кислот метилмалоновой кислоты в янтарную кислоту. Нормальный ход этой реакции обеспечивает оптимальный метаболизм миелина в нервной системе и требует присутствия активной формы фолиевой кислоты.
Этиология
Основные причины развития В12-дефицитной анемии:
- Нарушение секреции желудком «внутреннего фактора» , гастромукопротеина встречаются при атрофическом аутоиммунном гастрите с продукцией антител к париетальным клеткам и гастромукопротеину, тотальной гастрэктомии (реже , субтотальной резекции желудка), раке и полипозе желудка, токсическом действие высоких доз алкоголя на слизистую оболочку желудка.
- Нарушение всасывания витамина В12 в тонком кишечнике у больных с резекцией участка подвздошной кишки (более 60 см), при синдроме мальабсорбции различного генеза (ферментные энтеропатии, целиакия, тропическое спру, энтериты, болезнь Крона, амилоидоз кишечника), и лимфоме тонкой кишки. Замедлено всасывание В12 у больных хроническим панкреатитом с нарушением секреции трипсина. Снижают всасывание витамина В12 ряд лекарственных средств (колхицин, неомицин, бигуаниды, циметидин и др.).
- Конкурентное расходование витамина В12 встречается при инвазии глистами (широкий лентец, власоглав и др.).
- Повышенный расход витамина В12 наблюдается при многоплодной беременности, хронической гемолитической анемии, миелопролиферативных заболеваниях, новообразованиях, тиреотоксикозе.
- Нарушение поступления витамина В12 с пищей обусловлено неполноценным питанием или строгой вегетарианской диетой.
- Снижение запасов витамина В12 имеет место при выраженном циррозе печени.
Патогенез
При дефиците витамина В12 развиваются следующие нарушения.
Недостаток кофермента витамина В12 метилкобаламина приводит к нарушению синтеза тимидина, включаемого в ДНК, вследствие этого нарушается синтез ДНК и процессы митоза в клетках организма. Наиболее значительно страдают быстрорастущие ткани , клетки костного мозга, эпителий желудочно-кишечного тракта. Клетки костного мозга утрачивают способность к нормальному созреванию. Особенно выражены нарушения со стороны красного кроветворного ростка. Появляется большое количество мегалобластов. Мегалобластный эритропоэз характеризуется задержкой созревания ядер эритрокариоцитов по сравнению со степенью гемоглобинизации цитоплазмы, сокращением продолжительности жизни красных кроветворных клеток, повышенным распадом мегалобластов в костном мозге.
Эритропоэз при В12-дефицитной анемии становится неэффективным, что, подтверждается несоответствием между повышенным количеством эритрокариоцитов в костном мозге и резким снижением содержания ретикулоцитов в периферической крови, увеличением сывороточного железа и уменьшением включения радиоактивного железа в эритрокариоциты.
Одновременно отмечаются нарушение и неэффективность гранулоцитопоэза и тромбоцитопоэза. Появляются гигантские формы тромбоцитов, гранулоцитов, увеличивается фагоцитоз нейтрофилов костномозговыми макрофагами. Могут появляться аутоантитела к нейтрофилам, что также способствует развитию нейтропении у больных В12, дефицитной анемией.
Таким образом, дефицит витамина В12 приводит к неэффективности гемопоэза с развитием мегалобластной анемии, лейкопении и тромбоцитопении. Кроме того, происходит нарушение созревания эпителиальных клеток желудочно-кишечного тракта, что обусловливает развитие атрофии слизистой оболочки желудка и тонкого кишечника.
Недостаток кофермента витамина В12 дезоксиаденозилкобаламина приводит к нарушению обмена жирных кислот и накоплению в большом количестве токсичных для нервной системы метилмалоновой и пропионовой кислот. В отсутствие витамина В12 метилмалоновая кислота не превращается в янтарную кислоту. В результате развивается повреждение задних и боковых столбов спинного мозга, а также снижается синтез миелина в нервных волокнах.
Клиническая картина
Развитие заболевания характерно преимущественно для возраста 60-70 лет. Клиническая картина В12-дефицитной анемии характеризуется поражением трех систем: пищеварительной, кроветворной и нервной.
Поражение пищеварительной системы
У подавляющего большинства больных симптомы поражения системы органов пищеварения (прежде всего субъективные) могут быть наиболее ранними признаками заболевания. Больные жалуются на снижение или отсутствие аппетита, ощущение тяжести в подложечной области после еды, отрыжку съеденной пищей и воздухом, боль и жжение в языке, в области десен, губ, иногда в области прямой кишки. Указанные жалобы больных обусловлены развитием глоссита, атрофического гастрита и атрофическими изменениями слизистой оболочки кишечника.
При осмотре полости рта обращают на себя внимание воспалительно-атрофические изменения слизистой оболочки полости рта и языка. Для В12-дефицитной анемии характерен гладкий «лакированный» язык с атрофированными сосочками, потрескавшийся, с участками воспаления ярко-красного цвета (воспаленным и красным может оказаться весь язык), иногда с изъязвлениями. Глоссит наблюдается только при значительном и длительном дефиците витамина В12, приблизительно у 25% больных. Глоссит характерен не только для В12-де-фицитной анемии, он может наблюдаться и при железодефицитной анемии. Слизистая оболочка полости рта бледна, могут отмечаться явления афтозного стоматита. При пальпации живота может определяться неинтенсивная боль в эпигастральной области, нередко , увеличение печени и селезенки.
Поражение кроветворной системы
Нарушение системы кроветворения является ведущим в клинической картине заболевания и характеризуется анемией различной степени выраженности. Больные предъявляют жалобы характерные для анемического синдрома. Кожа обычно бледная, очень часто с лимонно-желтым оттенком (в связи с гипербилирубинемией, обусловленной гемолизом). Иногда при В12, дефицитной анемии повышается температура тела (не выше 38°С).
Поражение нервной системы
Изменения нервной системы при В12-дефицитной анемии являются характерным признаком этого заболевания и, как правило, наблюдаются при тяжелом и длительном течении. Поражение нервной системы при В12-дефицитной анемии называется фуникулярным миелозом и характеризуется вовлечением в процесс задних и боковых столбов спинного мозга. Наступает демиелинизация, а затем дегенерация нервных волокон в спинном мозге и спинномозговых нервах. Больные жалуются на слабость в ногах, особенно при подъеме по лестнице, при быстрой ходьбе, ощущение ползания мурашек по ногам, онемение ног. Больным кажется, что они не чувствуют при ходьбе опоры под ногами. Создается впечатление, что нога наступает не на твердую землю, а на что-то рыхлое, мягкое, как вата. Указанные жалобы обусловлены нарушением проприоцептивной чувствительности.
При преобладании поражения задних столбов нарушается глубокая, пространственная, вибрационная чувствительность, появляются сенсорная атаксия, затруднения при ходьбе, снижаются сухожильные рефлексы, наблюдается атрофия мышц нижних конечностей. Может наступить нарушение функции тазовых органов (недержание мочи, недержание кала).
При поражения боковых столбов спинного мозга неврологическая симптоматика иная: развивается нижний спастический парапарез с резким повышением сухожильных рефлексов и тонуса мышц нижних конечностей, нарушение функции тазовых органов характеризуется задержкой мочеиспускания и дефекации.
Лабораторные данные
Исследование периферической крови и костного мозга имеют решающее значение в диагностике заболевания.
Общий анализ крови. Характерно развитие гиперхромной макроцитарной анемии (цветовой показатель более 1,1). Изредка анемия может быть нормохромной. Эритроциты большие (макроциты), имеется анизоцитоз (разная величина эритроцитов, наряду с макроцитами имеются нормоциты), пойкилоцитоз (изменение формы эритроцитов). Во многих мегалоцитах (макроцитах) обнаруживаются остатки ядра (тельца Жолли, кольца Кебота), возможно наличие базофильной пунктуации. Часто в периферической крови обнаруживаются нормобласты, количество ретикулоцитов у большинства больных снижено или нормальное. Количество лейкоцитов снижено, определяются нейтропения, эозинопения, относительный лимфоцитоз. Для В12-дефицитной анемии чрезвычайно характерно появление больших сегментоядерных нейтрофилов с полисегментированным ядром. Количество тромбоцитов снижено, однако геморрагических проявлений, как правило, нет, потому что тромбоцитопения не достигает критической величины.
Миелограмма. Характерными признаками В12-дефицитной анемии, позволяющими верифицировать диагноз, являются:
- гиперплазия красного кроветворного ростка, клетки красного ряда преобладают над клетками белого ряда,
- появление мегалобластного типа кроветворения,
- изменение клеток миелоидного ряда — они увеличиваются в размерах, встречаются большие метамиелоциты (юные), палочкоядерные, сегментоядерные нейтрофилы, характерно появление гиперсегментированных нейтрофилов,
- нарушение созревания мегакариоцитов, выражающееся в нарушении отшнуровки тромбоцитов (непостоянный признак).
Биохимический анализ крови — специфических изменений не существует. Однако при В12-дефицитной анемии часто наблюдается гемолитический синдром, обусловленный внутрикостномозговым распадом эритрокариоцитов, а также укорочением продолжительности жизни периферических эритроцитов. Это проявляется неконъюгированной гипербилирубинемией. Возможно повышение содержания в крови ЛДГ, и ЛДГ2. Часто отмечается умеренное повышение содержания железа в сыворотке крови (при развитии гемолиза).
Анализ мочи и кала — при развитии гемолиза в моче выявляется уробилин, в кале — увеличено количество стеркобилина.
Инструментальные исследования
Эзофагогастродуоденоскопия — наблюдаются атрофические изменения слизистой оболочки пищеварительного тракта. Характерно развитие диффузного атрофического гастрита, дуоденита, реже атрофического эзофагита.
Исследование желудочной секреции — выявляется уменьшение количества желудочного сока, отсутствие соляной кислоты (ахилия) и пепсина, иногда снижение соляной кислоты.
Рентгеноскопия желудка — обнаруживаются нарушения эвакуаторной функции желудка, уплощение и сглаженность складок слизистой оболочки.
Диагноз
Диагностические критерии В12-дефицитной анемии:
I. Основные диагностические критерии.
- Гиперхромный характер анемии (изредка цветовой показатель нормальный).
- Характерные изменения эритроцитов периферической крови: увеличение диаметра (макроцитоз), объема, сохранение остатков ядра (тельца Жолли, кольца Кэбота), ретикулоцитопения.
- Характерные изменения со стороны лейкоцитов периферической крови: лейкопения, гиперсегментация нейтрофилов.
- Тромбоцитопения.
- Характерные изменения миелограммы: появление в костном мозге мегалобластов, гиперплазия красного кроветворного ростка, гиперсегментация нейтрофилов (стернальную пункцию следует производить до лечения витамином В12, так как даже 1-2 инъекции витамина В12 приводят к исчезновению мегалобластов).
- Развитие клинической картины фуникулярного миелоза (как правило, при тяжелом и длительном течении заболевания).
- Низкое содержание витамина В12 в крови.
II. Дополнительные диагностические критерии.
- Атрофический гастрит, отсутствие соляной кислоты, пепсина и гастромукопротеина в желудочном соке.
- Обнаружение в крови антител к париетальным клеткам желудка, гастромукопротеину или комплексу «витамин В12 гастромукопротеин».
- Ретикулоцитарный криз (на 5-7 день лечения В12 резко возрастает количество ретикулоцитов в периферической крови).
Фолиево дефицитная анемия (ФДА)
ФДА относится к группе мегалобластных анемий. Развитие мегалобластного типа кроветворения обусловлено тем, что при дефиците фолиевой кислоты нарушается влияние витамина В12 на синтез ДНК.
Основные сведения о метаболизме фолиевой кислоты
Фолиевая кислота водорастворимый, термолабильный витамин. В пищевых продуктах и в клетках организма фолиевая кислота содержится в виде фолиевокислых солей , полиглутаматов (фолатов). Фолаты содержатся в мясе, печени, растительных продуктах (шпинат, спаржа, салат, бобовые, овощи, фрукты, грибы), дрожжах, молоке. При кулинарной обработке, длительной варке более 50% фолатов разрушается, поэтому для обеспечения потребностей организма в фолатах необходимо употреблять свежие овощи и фрукты. Всасывание фолатов происходит в 12-перстной кишке и проксимальном отделе тощей кишки. В крови 5-метилтетрагидрофолат связывается с различными белками, поступает в печень и быстро пролиферирующие клетки костного мозга. Проникновение фолатов через мембрану и накопление их в клетке происходит с участием витамина В12.
Фолиевая кислота участвует в следующих биохимических реакциях:
- вместе с витамином В12 участвует в синтезе тимидинмонофосфата из уридинфосфата. Тимидинмонофосфат участвует в синтезе пиримидиновых оснований и ДНК. Следовательно, фолиевая кислота необходима для синтеза ДНК,
- участвует в синтезе пуриновьгх оснований, которые входят в состав ДНК и РНК,
- принимает участие в образовании глутаминовой кислоты из гистидина. При дефиците фолиевой кислоты нарушается синтез ДНК в кроветворных клетках, развивается мегалобластная анемия.
Показатели нормального обмена фолиевой кислоты:
Суточная потребность в фолиевой кислоте , 100-200 мкг. Общее количество поступающей с пищей фолиевой кислоты при полноценном питании , 500-600 мкг/сут. Количество фолатов, всасывающихся в кишечнике , 400- 480 мкг/сут. Общее содержание фолатов в организме — 5-10 мг. Срок, в течение которого депо обеспечивает потребность в фолиевой кислоте при прекращении ее поступления в организм , 4-5 мес.
Этиология
Недостаточное поступление фолатов с пищей
Алиментарная недостаточность фолатов частая причина ФДА. Она развивается при недостаточном употреблении в пищу овощей и фруктов, мяса и других продуктов, содержащих фолаты, а также при неправильной их кулинарной обработке. ФДА может развиваться у детей грудного возраста при вскармливании козьим молоком, различными питательными смесями, содержащими мало или совсем не содержащими фолатов, при исключении из рациона овощей, фруктов, мяса.
Нарушение всасывания фолатов в тонком кишечнике
Причины, обусловливающие нарушение всасывания фолатов в кишечнике, аналогичны тем, которые нарушают всасывание витамина B12: врожденные нарушения транспорта фолатов через стенку тонкой кишки, обширная резекция тонкой кишки, особенно тощей, энзимодефицитные энтеропатии, синдром мальабсорбции различного генеза, синдром «слепой кишки», опухолевые заболевания тонкого кишечника.
Повышенная потребность в фолатах
Повышенная потребность в фолатах наблюдается у детей любого возраста, но особенно часто у детей первого года жизни, а также в периоды интенсивного роста, полового созревания. Повышенная потребность в фолатах характерна для беременности, хронических воспалительных заболеваний, хронических гемолитических анемий, эксфолиативного дерматита, злокачественных новообазований, в том числе гемобластозов.
Хроническая алкогольная интоксикация
Алкоголь нарушает всасывание фолатов в тонком кишечнике, поэтому хроническое злоупотребление алкоголем может приводить к ФДА.
Повышенная потеря фолатов
Может наблюдаться при тяжело протекающем циррозе печени (уменьшается депо фолатов в печени), гемодиализе, сердечной недостаточности.
Прием лекарственных препаратов
- Некоторые лекарственные препараты (бисептол, сульфалазин, аминоптерин и метотрексат, триамтерен и др. могут вызывать развитие ФДА.
Патогенез
Вышеприведенные этиологические факторы приводят к уменьшению образования активной формы фолиевой кислоты , 5,10-метилентетрагидрофолиевой кислоты. В итоге нарушается синтез ДНК в кроветворных клетках и развивается мегалобластная анемия.
Клиническая картина
Заболевание чаще всего развивается у детей, молодых людей и у беременных женщин.
Больные предъявляют жалобы, характерные для анемии любого генеза , отмечается неспецифический анемический синдром. Однако, в отличие от В12-дефицитной анемии отсутствуют жалобы, обусловленные поражением нервной системы. При осмотре обращает на себя внимание бледность кожи, субиктеричность. При исследовании внутренних органов можно обнаружить небольшое увеличение селезенки (непостоянный признак) и синдром миокардиодистрофии (приглушенность сердечных тонов, негромкий систолический шум на верхушке, нарушение фазы реполяризации миокарда левого желудочка на ЭКГ в виде снижения амплитуды зубцов Т). В отличие от В12-дефицитной анемии для ФДА характерно отсутствие атрофического глоссита, атрофического гастрита и ахилии.
Лабораторные данные
Общий анализ крови , характерны те же признаки, что и при В12-дефицитной анемии.
Биохимический анализ крови — может наблюдаться увеличение количества неконъюгированного билирубина (вследствие гемолиза эритроцитов), снижение содержания фолиевой кислоты в крови и эритроцитах.
Миелограмма , характерна гиперплазия красного кроветворного ростка, появление большого количества мегалобластов, гиперсегментированных нейтрофилов.
Проба с гистидином , больной принимает 15 г гистидина, после чего определяется экскреция с мочой формиминглутаминовой кислоты за 8 ч после приема гистидина. В норме основная часть гистидина превращается при участии фолиевой кислоты в глутаминовую кислоту, с мочой выводится от 1 до 18 мг формиминглутаминовой кислоты. При фолиеводефицитной анемии выделение формиминглутаминовой кислоты значительно увеличивается.
Диагностические критерии ФДА.
- Общий анализ периферической крови: гиперхромная анемия, макроцитоз эритроцитов, гиперсегментация нейтрофилов, лейкопения, тромбоцитопения.
- Миелограмма , обнаружение мегалобластов, гиперсегментированных нейтрофилов.
- Отсутствие глоссита, атрофического гастрита.
- Отсутствие фуникулярного миелоза.
- Нормальное содержание в крови витамина В12.
- Сниженное содержание фолиевой кислоты в сыворотке крови и эритроцитах.
- Нормальная суточная экскреция с мочой метилмалоновой кислоты.
Лечение В12-дефицитной и ФДА
К лечению В12 -дефицитной анемии витамином В12 можно приступать только после установления и верификации диагноза с помощью миелограммы. Даже 1-2 инъекции витамина В12, не устраняя синдром анемии, могут трансформировать мегалобластическое кроветворение в нормобластическое и сделать стернальную пункцию неинформативной.
Лечение В12-дефицитной анемии проводится внутримышечными инъекциями витамина В12. Имеются два препарата витамина В12 — цианокобаламин и оксикобаламин.
Цианокобаламин назначают по 400-500 мкг внутримышечно 1 раз в день (оксикобаламин по 1 мг/сут через день). Длительность курса лечения составляет 4-6 недель. На 3-4-й день от начала лечения витамином В12 начинается увеличение содержания ретикулоцитов в крови. После курса лечения назначается курс закрепляющей терапии: цианокобаламин вводят 1 раз в неделю в течение 2 месяцев, а затем постоянно 2 раза в месяц по 400-500 мкг. Оксикобаламин: в течение 3 месяцев его вводят 1 раз в неделю, а затем постоянно 1 раз в месяц по 500 мкг.
При фуникулярном миелозе назначают большие дозы витамина В12 (1000 мкг ежедневно) в сочетании с коферментом витамина В12 кобамамидом (500 мкг 1 раз в день внутримышечно), который участвует в обмене жирных кислот и улучшает функциональное состояние спинного мозга и нервных волокон. Эта доза витамина В12 вводится до исчезновения клиники миелоза.
Препараты фолиевой кислоты назначают лишь больным с ФДА. Назначают фолиевую кислоту внутрь в суточной дозе 5-15 мг. При В12-дефицитной анемии лечение фолиевой кислотой не показано.
Лечение В12-дефицитной анемии проводится пожизненно, диспансерное наблюдение должно осуществляться постоянно.
Гипо и апластические анемии
Гипо и апластические анемии , это нарушения гемопоэза, характеризующиеся редукцией эритроидного, миелоидного и мегакариоцитарного кроветворных ростков костного мозга и панцитопенией в крови, не сопровождающаяся гепатоспленомегалией, при отсутствии миелофиброза, острого лейкоза или миелодиспластического синдрома.
Патоморфологической основой гипо и апластических анемий является резкое сокращение активного кроветворного костного мозга и замещение его жировой тканью. Заболевание встречается с частотой 5-10 случаев на 1 млн. жителей в год.
Этиология
В зависимости от этиологических факторов различают врожденную (наследственную) и приобретенную гипо- и апластическую анемию. В свою очередь приобретенная гипо- и апластическая анемия подразделяется на идиопатическую (с неизвестной этиологией) форму и форму с известными этиологическими факторами. Идиопатическая форма составляет 50-65% всех случаев апластической анемии.
Известные этиологические факторы приобретенной апластической анемии:
- Химические факторы: бензол, неорганические соединения мышьяка, этилированный бензин (содержит тетраэтилсвинец, тяжелые металлы , ртуть, висмут и др.), хлорорганические соединения и т.д.
- Физические факторы: ионизирующая радиация и рентгеновское излучение.
- Лекарственные средства: антибиотики (хлорамфеникол, метициллин и др.), сульфаниламиды, нестероидные противовоспалительные средства (бутадион, индометацин, анальгин), препараты золота, мерказолил, цитостатики, антиаритмические средства (хинидин), гипотензивные средства (каптоприл, эналаприл, допегит) и др.
- Инфекционные агенты: вирусы инфекционного мононуклеоза, гепатита, гриппа, Эпштейна-Барр, иммунодефицита человека, цитомегаловирусы, герпеса, эпидемического паротита.
- Иммунные заболевания: болезнь «трансплантат против хозяина», эозинофильный фасциит, тимома и карцинома тимуса.
Патогенез
В настоящее время основными патогенетическими факторами апластической анемии считаются:
- поражение полипотентной стволовой гемопоэтической клетки,
- поражение клеточного микроокружения стволовой кроветворной клетки и опосредованное нарушение ее функции,
- иммунная депрессия кроветворения и апоптоз стволовых кроветворных клеток,
- укорочение жизни эритроцитов,
- нарушение метаболизма кроветворных клеток.
Поражение полипотентной стволовой гемопоэтической клетки — важнейший патогенетический фактор апластической анемии. Стволовая клетка является родоначальницей всех кроветворных клеток. При апластической анемии значительно снижается колониеобразующая способность костного мозга, нарушается пролиферация кроветворных клеток, в конечном итоге формируется синдром панцитопении — лейкопения, анемия, тромбоцитопения. Окончательно механизм угнетения активности полипотентной стволовой кроветворной клетки не выяснен.
Поражение клеточного микроокружения стволовой кроветворной клетки. В настоящее время установлено, что на функциональное состояние стволовой кроветворной клетки и полипотентных клеток-предшественниц большое влияние оказывает микроокружение, т. е. строма костного мозга. Клетки микроокружения обуславливают деление и дифференцировку стволовых клеток. Основными клеточными компонентами микроокружения стволовой клетки являются остеобласты, фибробласты, эндостальные, адвентициальные, эндотелиальные и жировые клетки. В связи с большой ролью микроокружения в кроветворении, предложен термин «индуцирующее кроветворение микроокружение» (ИКМ). Для нормального развития гемопоэтических клеток нужны гемопоэтические факторы роста (ГФР) и колониестимулирующие факторы роста (КСФ) — гликопротеиновые гормоны, которых идентифицировано около двадцати. Под влиянием ГРФ и КСФ происходит деление и дифференцировка гемопоэтических клеток. При апластической анемии внутренний дефект полипотентной стволовой клетки является первичным нарушением, которое проявляется или усиливается при воздействии различных этиологических факторов на гемопоэтические клетки через изменение ИКМ.
Большое значение в развитии апластической анемии придается иммунным механизмам. Предполагается, что происходит блокирование Т-лимфоцитами дифференциации стволовых клеток, образуются антитела к стволовым клеткам, эритроцитам, клеткам , предшественницам разных линий кроветворения, что приводит к депрессии гемопоэза. При взаимодействии гемопоэтических стволовых кроветворных клеток с активированными цитотоксическими Т-лимфоцитами и некоторыми цитокинами стимулируется апоптоз (запрограммированная клеточная смерть) стволовых клеток гемопоэза.
При апластической анемии могут возникать нарушения ферментных систем в эритроцитах, что делает их гиперчувствительными к различным повреждающим факторам и приводит к их внутримозговому разрушению. Значительные изменения претерпевает метаболизм кроветворных клеток, вследствие чего клетки всех кроветворных ростков не усваивают в достаточной мере вещества необходимые для оптимального гемопоэза (железо, витамин В12).
Снижение интенсивности пролиферации и дифференциации клеток красного ряда кроветворения, повышенное разрушение эритроцитов, неоптимальное использование железа и нарушение гемоглобинообразования приводят к накоплению в организме железа с отложением железосодержащих пигментов в различных органах и тканях (печени, селезенке, коже, миокарде, надпочечниках и др.) — т. е. развивается вторичный гемохроматоз.
Классификация
I. Наследственные формы
II. Приобретенные формы
- Гипопластическая анемия с поражение всех трех кроветвроных ростков:
- Парциальная гипопластическая анемия с избирательным поражением эритропоэза.
III.Роль иммунных факторов в развитии анемии
- Иммунная форма
- Неиммунная форма.
Клиническая картина
Основная клиническая и лабораторная симптоматика приобретенной гипо- и апластической анемии с поражением всех трех кроветворных ростков костного мозга обусловлена тотальным угнетением гемопоэза, а также гипоксией органов и тканей и геморрагическим синдромом. Выраженность симптоматики зависит от степени тяжести и варианта течения анемии.
Больные предъявляют жалобы характерные для анемического синдрома. Характерны кровоточивость (десневые, носовые, желудочно-кишечные, почечные, маточные кровотечения) и частые инфекционно-воспалительные заболевания. При острой форме симптомы развиваются быстро и течение заболевания с самого начала тяжелое. Но у большинства больных заболевание развивается достаточно медленно, постепенно, в определенной мере пациенты адаптируются к анемии. Заболевание обычно распознается при выраженной симптоматике.
При осмотре больных обращает на себя внимание выраженная бледность кожи и видимых слизистых оболочек, часто с желтушным оттенком, геморрагические высыпания на коже, чаще в виде кровоподтеков различной величины. Часто на месте инъекций (внутримышечных, внутривенных, подкожных) образуются обширные гематомы. Геморрагическая сыпь локализуется преимущественно в области голеней, бедер, живота, иногда на лице. Могут наблюдаться кровоизлияния в конъюнктиву и видимые слизистые оболочки — губы, слизистую оболочку полости рта. Могут быть тяжелые носовые, желудочно-кишечные, почечные, легочные, маточные, внутрицеребральные кровотечения. Периферические лимфоузлы не увеличены.
При исследовании внутренних органов могут обнаруживаться следующие изменения:
- Система органов дыхания — частые бронхиты, пневмонии.
- Сердечно-сосудистая система — синдром миокардиодистрофии.
- Система органов пищеварения — при выраженном геморрагическом синдроме могут обнаруживаться эрозии на слизистой оболочке желудка, 12-перстной кишки.
Нередко развивается гемосидероз внутренних органов вследствие повышенного разрушения неполноценных эритроцитов, снижения использования железа костным мозгом, нарушения синтеза гема, частых переливаний эритроцитарной массы.
Лабораторные данные и инструментальные исследования
Общий анализ крови , выраженное снижение количества эритроцитов и гемоглобина, анемия у большинства больных нормохромная, нормоцитарная, характерно отсутствие или резкое снижение количества ретикулоцитов (арегенераторная анемия), наблюдается лейкопения за счет гранулоцитопении с относительным лимфоцитозом, характерна тромбоцитопения. Таким образом, наиболее существенным лабораторным проявлением гипо- и апластической анемии является панцитопения. СОЭ увеличена.
Биохимический анализ крови — содержание сывороточного железа повышено, процент насыщения железом трансферина значительно увеличен.
Исследование стернального пунктата (миелограмма) — выраженное уменьшение клеток эритроцитарного и гранулоцитарного рядов, лимфоцитов и значительная редукция мегакариоцитарного ростка. В тяжелых случаях костный мозг выглядит «опустошенным», в стернальном пунктате можно обнаружить лишь единичные клетки. В костном мозге значительно увеличивается содержание железа, расположенного как внеклеточно, так и внутриклеточно.
Диагностические критерии
- Нормохромная нормоцитарная арегенераторная анемия с резким снижением или полным отсутствием ретикулоцитов, увеличением СОЭ.
- Лейкоцитопения, абсолютная гранулоцитопения, относительный лимфоцитоз.
- Тромбоцитопения.
- Резко выраженный абсолютный дефицит в миелограмме клеток эритро-, лейко- и тромбоцитопоэза, задержка их созревания.
• Увеличение содержания железа внутри эритрокариоцитов и внеклеточно.
- Резкое уменьшение количества или полное исчезновение кроветворных клеток и замещение кроветворного костного мозга жировой тканью в трепанобиоптате подвздошной кости является основным методом верификации диагноза гипо- и апластической анемии).
- Повышение уровня сывороточного железа.
Лечение гипопластических (апластических) анемий
Лечебная программа:
- Лечение глюкокортикоидами.
- Лечение анаболическими препаратами.
- Лечение андрогенами.
- Лечение цитостатиками (иммунодепрессантами).
- Спленэктомия.
- Лечение антилимфоцитарным глобулином.
- Лечение циклоспорином.
- Пересадка костного мозга.
- Лечение колониестимулирующими факторами.
- Трансфузии эритроцитов.
- Десфералотерапия.
- Трансфузии тромбоцитов.
- Лечение иммуноглобулином.
Лечение глюкокортикоидами
Глюкокортикоидная терапия наиболее эффективна, если гипопластическая анемия обусловлена аутоиммунными механизмами, появлением антител против клеток крови. Однако глюкокортикоиды применяются и при других вариантах депрессии костного мозга в связи со способностью стимулировать эритроцитарный, нейтрофильный и мегакариоцитарный ростки кроветворения. Суточная доза преднизолона составляет 1-2 мг/кг массы больного в сутки, чаще всего доза колеблется от 60 до 120 мг в сутки. Длительность терапии преднизолоном зависит от эффекта в первые 2 недели от начала лечения. Если есть эффект, то лечение преднизолоном продолжают с переходом на поддерживающие дозы 15-20 мг после значительного улучшения гемограммы. Если эффекта нет, то дальнейшее лечение преднизолоном (более 2 недель) бесполезно. Лечение преднизолоном может продолжаться от 4 недель до 3-4 мес.
Лечение анаболическими препаратами
Анаболические стероидные препараты, с одной стороны, нивелируют катаболические эффекты глюкокортикоидов, с другой , стимулируют кроветворение. Назначают неробол по 20 мг/сут или более эффективный aнaполон (оксиметолон) по 200 мг/сут в течение 5-6 месяцев. Лечение анаболиками показано также после спленэктомии.
Лечение андрогенами
Андрогены обладают анаболическим эффектом и стимулируют эритропоэз. Повышение уровня гемоглобина отмечается у 50% больных, нейтрофильных лейкоцитов — у 30%, тромбоцитов — у 25% больных. Суточные дозы андрогенов составляют 1-2 мг/кг, иногда — 3-4 мг/кг. Вводится тестостерона пропионат 5% раствор по 1 мл 2 раза в сутки или препарат продленного действия сустанон-250 1 раз в месяц (в 1 мл содержится 250 мг мужских половых гормонов). Эффект андрогенов наступает постепенно, поэтому лечение проводится длительно в течение нескольких месяцев. При уменьшении дозы или отмене андрогенов у некоторых больных возможно обострение заболевания. Лечение андрогенами проводится только мужчинам.
Лечение цитостатиками (иммунодепрессантами)
Иммунодепрессантная терапия назначается лишь при отсутствии эффекта от других методов лечения у больных с аутоиммунной формой гипопластической анемии. Азатиоприн (имуран) по 0,05 г 2-3 раза в день с постепенным уменьшением дозы после получения эффекта. Длительность курса лечения может составить 2-3 месяца.
Спленэктомия
Спленэктомия показана при отсутствии эффекта от глюкокортикоидов всем больным, если они не имеют септических осложнений. Положительный эффект спленэктомии наблюдается у 84% больных и обусловлен уменьшением продукции антител против кроветворных клеток, а также уменьшением секвестрации клеток крови.
Лечение антилимфоцитарным глобулином
Лечение антилимфоцитарным глобулином рекомендуется при отсутствии эффекта от спленэктомии и других методов лечения. Препарат подавляет образование антител против клеток крови. Вводится внутривенно капельно по 120-160 мг антилимфоцитарного глобулина 1 раз в день в течение 10-15 дней.
Иммуносупрессивная терапия с помощью антилимфоцитарного глобулина, умеренных доз глюкокортикоидов и андрогенов является методом выбора у больных апластической анемией, не имеющих HLA-идентичного донора, и которым, следовательно, не может быть произведена пересадка костного мозга.
Лечение циклоспорином
Циклоспорин А , обладает иммунодепрессантным эффектом. Является эффективным средством лечения апластической анемии, гематологическая ремиссия достигается у 40-50% больных. Применяется внутрь в виде масляного раствора или в капсулах в дозе 4 мг/кг/сут в 2 приема. При отсутствии токсических явлений лечение может продолжаться в течение нескольких месяцев.
Пересадка костного мозга
В настоящее время трансплантация костного мозга является основным методом лечения гипопластической анемии при отсутствии эффекта от других методов лечения. Производится пересадка подобранного и совместимого по HLA-системе костного мозга. Перед трансплантацией производится предварительная иммунодепрессия цитостатиками и облучением. Достижение ремиссия после миелотрансплантации отмечено у 80-90% больных с тяжелой апластической анемией. Наилучшие результаты получены у лиц не старше 30 лет. Трансплантацию следует применять не позднее 3 месяцев с момента установления диагноза тяжелой аплазии.
Лечение колониестимулирующцми факторами
Колониестимулирующие факторы (КСФ) , это гликопротеиды, стимулирующие пролиферацию и дифференциацию клеток-предшественников различных типов.
Препараты гранулоцитарного КСФ филграстим, ленограстим, нартограстим преимущественно стимулируют образование нейтрофилов, препараты гранулоцитарно-макрофагального КСФ молграмостим, сарграмостим, лейкомакс стимулируют продукцию эозинофилов, нейтрофилов, моноцитов. Основным показанием к назначению КСФ является нейтропения различной природы, в том числе при апластической анемии, повышающая риск развития угрожающих жизни инфекций. КСФ применяются в дополнение к другим методам терапии. Применяются рекомбинантные препараты КСФ внутривенно в дозе 5 мкг/кг/сут в течение 14 дней.
Трансфузии эритроцитов
Показаниями к трансфузии эритроцитов являются выраженная анемия, признаки гипоксии мозга, гемодинамические нарушения. Частые переливания эритроцитов создают опасность развития гиперсидероза и депрессивного влияния на эритроцитопоэз. В связи с этим гемотрансфузии строго лимитируются уровнем гемоглобина. Его повышение до 80-90 г/л является достаточным для устранения гипоксии тканей. Если 250-450 мл эритроцитарной массы, перелитые в течение недели, поддерживают содержание гемоглобина на уровне 90-100 г/л, то более частые гемотрансфузии не нужны.
Десфералотерапия
При гипопластической (апластической) анемии имеется значительное накопление железа в клетках гемопоэза, особенно эритропоэза. Это обусловлено депрессией гемопоэза, снижением утилизации железа, недостаточным образованием протопорфирина IX. Избыток железа может нарушать функцию клеток гемопоэза вплоть до их гибели. Поэтому в комплексную терапию гипопластической анемии включают препарат десферриоксалин (десферал), избирательно связывающий и выводящий из организмам человека трехвалентное железо. Препарат быстро выводится через почки в виде ферроксамина, придавая моче красноватый оттенок. Десферал вводят внутримышечно или внутривенно по 500 мг 2 раза в день в течение не менее 2-3 недель. После перерыва на 3-4 недели целесообразно провести еще 2-4 таких таких курса. У 50% больных после лечения десфералом показатели гемопоэза улучшаются.
Трансфузии тромбоцитов
Переливание тромбоцитов производится при выраженном геморрагическом синдроме, обусловленном тромбоцитопенией. Переливаются тромбоциты, полученные от одного донора.
Лечение иммуноглобулином
В последние годы для лечения гипопластических анемий рекомендуют внутривенное введение иммуноглобулина в дозе 400 мкг/кг массы тела в течение 5 дней подряд. Препарат стимулирует эритро- и тромбоцитопоэз.

